|
Hydrogen and Hydration in Proteins
Nobuo Niimura
Research Group for Neutron Structural Biology
Neutron diffraction provides an experimental method
of directly locating hydrogen atoms in proteins. High resolution neutron
diffractometers dedicated to biological macromolecules (BIX-type diffractometer)
have been constructed at the Japan Atomic Energy Research Institute (JAERI)
and they have been used in the 1.5A-resolution crystal structure analyses
of several proteins. Very interesting topics relevant to hydrogen and
hydration in proteins, such as hydrogen bonds, H/D exchange, acidic hydrogen
atom, the role of hydrogen atoms in enzyme mechanisms and thermostability,
and dynamical behaviors of hydration structures that include H positions
have been extracted from these structural results.
21世紀に入り、ヒトゲノムの解読が完了し、人間は自らの生命の設計図を手にし、いよいよこの設計図をもとに本格的な生命現象を理解する時代、ポストゲノム時代に入った。タンパク質やDNAは立体構造を形成して初めて機能を発揮する。立体構造解析の主流は放射光X線やNMRである。しかし、生理機能に直接関与する水素原子や完全な水和構造はX線やNMRでは決定困難である。生命現象の中で水素原子の果たす役割や生体物質と水との関わりは大変重要である。しかし、それらを原子レベルで観察した例は少なく、生命現象の中で水素原子の果たす役割や生体物質と水との関わりの多くは類推で議論される事が多かった。
これを可能にする唯一の実験手法が中性子回折法である。1) 我々は中性子イメージングプレート2)や高性能中性子モノクロメータを開発実用化し、これらを具備した世界最高性能の生体物質中性子回折計(BIX-2,
BIX-3, BIX-4)3)を原研JRR-3Mに設置した。これにより、リゾチーム4,5)、ミオグロビン6)、ルブレドキシン7.8)インスリン9)等基本的なタンパク質や最近オリゴマーDNAの全水素・水和構造決定を完了し、水素・水和構造に関し多くの知見を得た。すでに我々はこの「基礎科学ノート」に何度か研究成果の一部を紹介しているので10)、今回はそこで述べなかったことを中心に特に最近の成果を紹介する。
1.水素結合
水素結合は水素原子を介した化学結合のひとつであり, タンパク質の構造と機能を研究するのに重要な役割を演じている. 但し, X線結晶構造解析では,
水素原子を含まない構造が大部分であるので, 水素結合の同定はドナー(X)とアクセプター(Y)原子間距離を中心に議論されてきた. しかし, ドナー,
水素原子, アクセプターが同一直線上に乗るのケースは少ないのでドナーとアクセプター原子間距離だけで水素結合を議論するのは危険である. 中性子解析は水素原子を含んだ本質に迫った水素結合の議論が可能になる.
中性子回折法では水素原子が他の炭素、窒素、酸素原子と同様の精度でその位置が決定されるので、X-Hを水平軸にとり水素原子を原点に置き、アクセプター原子位置の分布をプロットすることができる。図1はルブレドキシンの水素結合の様子をこのようなプロットで示したものである。T.Steinerが水素結合を弱いものと強いものに区分したが、それらがこのプロットで明瞭に判る。
1951年ポーリングによって提案されたaヘリックス骨格構造はn番目のアミノ酸のC-Oとn+4番目のアミノ酸のN-Hが水素結合で結ばれ、ラセン構造をとる構造モデルである。これは先ずミオグロビンのX線結晶構造解析によってその存在と構造が確認されタンパク質立体構造構築の二次構造として普遍的なものとみなされるようになった。今回、我々は中性子回折法でミオグロビン等のaヘリックス中のすべての水素原子を決定したところ、骨格構造の水素結合の多くは確かにポーリングのモデルを支持する構造であるが、いくつかのn+4番目のアミノ酸のN-Hはn番目のアミノ酸のC-Oとだけでなくn+1番目のアミノ酸のC-Oとも水素結合していることが見い出された。これは2分岐結合と言われるものであるが、その観測例を図2に示す。
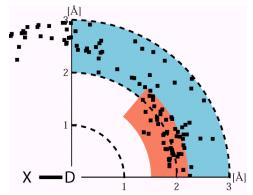
図1.水素結合の表示。X-Hを水平軸にとり水素原子を原点に置き、アクセプター原子位置の分布をプロットした図
2.H/D交換
中性子回折実験に用いる単結晶は、すでに述べたが、タンパク質周囲の水を重水に置換したものを用いる。すると一般に、アミド基の水素原子を始め、アミノ酸残基の窒素原子や酸素原子に結合している水素原子は重水素原子に置換される。しかし、詳細に調べてみると必ずしも重水素置換しない箇所があるのが判明した。中性子回折実験では水素原子の散乱長(X線での原子散乱因子に相当する。)は負で、重水素原子は正の値であり、フーリエマップ図でHとDの違いは一目瞭然である。図3にaヘリックス内で水素結合しているアミド基水素で重水素置換しているもの(a)としていないもの(b)を示す。そこで、水素の原子散乱長にH/D占有率を新たなパラメータとして導入し、精密化を行い、H/D交換率を求めた。図4にそれぞれルブレドキシン(野生型)の骨格アミド基水素のH/D交換率、温度因子、ASA
(Accessible Surface Area)を示してある。これら3つのパラメータは強い相関があることが明瞭に判る。重水素に置換しにくいアミド基の水素原子の特徴は、温度因子、ASA共に小さい箇所である。
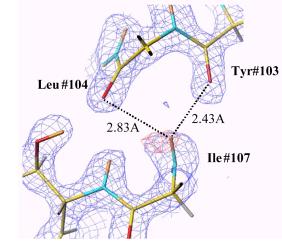 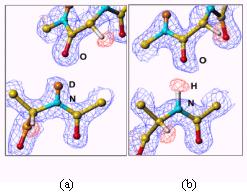
図2.2分岐水素結合の例 図3.aヘリックス内で水素結合しているアミド基水素で(a)重水素置換して いるものと(b)していないもの
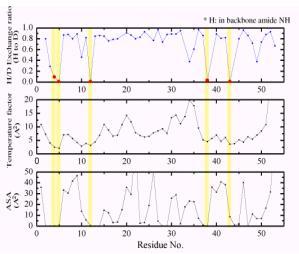
図4.ルブレドキシン(野生型)の骨格アミド基水素のH/D交換率、温度因子、ASA (Accessible Surface Area)
3.ヒスチジンの水素原子
アミノ酸残基の一つのヒスチジンはイミダゾール環を有し、それを構成する窒素原子(p,t)の結合状態(水素化、脱水素化)は反応性等に強く関係しているので重要な構造情報を提供する。x線では水素原子を見るのも困難であり、場合によっては炭素と窒素の区別も困難であるため、水素原子が見える中性子回折法はこれに関しては多くの情報を提供してくれる。図5にインスリンのB鎖5番目と10番目のヒスチジンの中性子回折による核密度フーリエ図を示す。それによると、B鎖5番目のHisはp窒素が水素化しt窒素が脱水素化していること、一方、B鎖10番目のヒスチジンではp,t窒素ともに水素化していることが判明した。
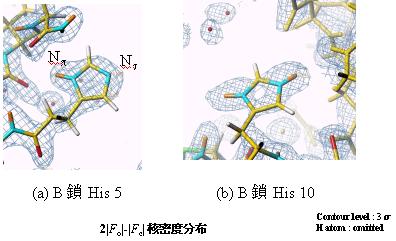
図5.インスリンのB鎖5番目と10番目のヒスチジンの核密度フーリエ図
また、ミオグロビン97番目のヒスチジンに関して図6に示すような大変興味ある水素原子が見いだされた。t窒素原子の水素化、p窒素の脱水素化が観測され、且つ二つの水素原子の間の炭素原子に結合した水素原子が重水素置換していることが判明した。これはこの炭素がp,t両窒素の電気陰性度により正に荷電し結合水素を酸性的にした結果と考えられる。
4.水和構造
タンパク質分子のダイナミックスの計算で水和水の導入により実測スペクトルをよりよく説明できることが判明しており、水和水の位置決定は、アミノ酸残基の種類、構造と水和水の関係を定量的に議論出来る基礎データを提供し、立体構造構築原理の研究に大きな寄与が期待できる。一般的に水溶性タンパク質は疎水性のアミノ酸が水分子に接しないように内側にきてコアを作り、電荷をもつアミノ酸や親水性のアミノ酸が外側にきて周囲の水と接するように立体構造を構築する。そして、周囲の水のいくつかは水和水としてタンパク質に結合して取り囲み、いわゆるバルクの水とは異なる振る舞いをする。X線解析でも水和水は酸素位置を同定することで観測されるが、水素原子を含めた水和水とアミノ酸残基との結合の様子は判らない。電荷をもつアミノ酸や親水性のアミノ酸と水分子との相互作用から考えられる水分子の配向の様子は3次元的に多様であり、アミノ酸残基に直接水和した水分子に更に結合する水分子のようにそのヴァリエイションは豊富である。水和構造の結合様式の大部分は水素結合と考えられるが、水和水のついたアミノ酸残基が水素結合のドナーになっているのか、アクセプターになっているのかは重要な因子でありタンパク質の立体構造構築に深く関わっている。これらは水素原子位置が確定されて始めてできる議論である。すでに述べたように中性子回折法ではこれが可能である。
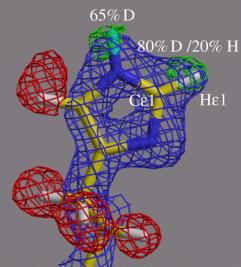
図6.ミオグロビン97番目のヒスチジンの水素のH/D交換状態
図7に今回の中性子回折で決められたミオグロビンの水和構造の例を示す。ブーメラン状に水素原子まで含めて水和水が明瞭に見え、2つの水和水が水素結合で結ばれている様子が判る。一方、その外側にボール状(図
7の左下隅)に見える水和水があるが、これは、水素原子まで含めて水分子がそのように見える、つまりこの水分子は回転運動していることの証拠である。〔種々の分子配向した水分子の重ね合わせモデルでも実験データは解釈可能である。〕X線回折では水和水の酸素位置が見えるので、水和水はすべてボール状に見える。しかし、中性子回折でボール状に見える水和水は分子のダイナミクスを反映してボール状に見えているのであり、含む情報は多い。
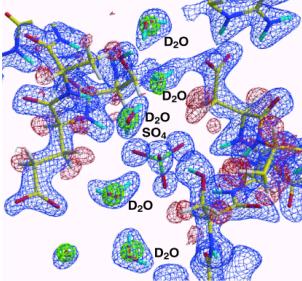
図7.ミオグロビンの水和構造の例
ミオグロビン、ルブレドキシン(野生型、変異体)の中性子回折で観測された水和水を分類してみた結果を図8に示す。これによると、三角型、長い棒型、短い棒型、球型の4種類に分類される。三角型は水和水を構成する酸素原子や水素原子が周囲の原子と水素結合で関係付けられ、配向がかなりユニークに決定される。短い棒型は水和水を構成する一方の水素原子が周囲の原子と水素結合で関係付けられ酸素・水素結合軸の周りの分子回転の結果もう一方の水素原子が見えにくくなっている。長い棒型は水和水両端の水素原子が周囲の原子と水素結合で関係付けられ水素---水素軸の周りの分子回転が生じている。そして球型は水和水分子重心周りの球回転(場合によっては任意の原子を中心にした球回転の可能性も否定できない。)と考えられる。
5.熱安定性
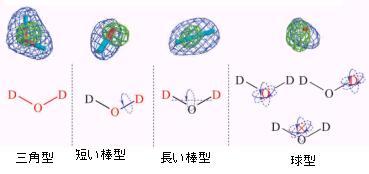
図8.ミオグロビン、ルブレドキシン(野生型、変異体)の中性子回折で観測された水和水の分類
超高熱菌(Pyrococcus furiosus)由来のRubredoxin (PfRdと呼ぶ。)は100°Cでも安定な構造を保てるが、常温菌(Clostridium
pasteurianum)由来のRubredoxin(CpRdと呼ぶ。)はPfRdと比べてアミノ酸残基の相同性が58%と高いにも拘らず、熱安定性は大変低い。PfRdの熱安定性の起因は構造の中核のHydrophobicな部分の安定性にあると予測されるので、その箇所のアミノ酸残基を比較したところ、3箇所に違いが見られた。そこで、PfRdの3箇所に変異を掛けた(Trp3-->Tyr3,
Ile23-->Val23, Leu32-->Ile32)変異体を作り、PfRd(W)とPfRd(M)の構造の違いが熱安定性に関する情報を与えるのではないかと考えた。その結果、中性領域では両方とも充分な熱安定性が保たれていたが、酸性領域ではPfRd(M)は熱安定性を失うことが判明した。両タンパク質についてすでにX線結晶構造解析はなされていたが、水素原子以外の情報からは両タンパク質にこのような熱安定性の差を説明できる情報は得られなかった。そこで、これら熱安定性の構造学的な解釈は水素原子の情報から得られるのではないかと考え、両タンパク質の中性子回折実験を行った。但し、残念なことに、酸性領域では、PfRd(W)、PfRd(M)とも結晶が得られなかったが、中性領域では中性子回折実験に耐える結晶が得られたので、それを用い中性子回折実験を行った。その結果、23番目と32番目の変異に関してはPfRd(W)、PfRd(M)の大きな差は無かったが、3番目の変異の箇所に面白い違いが見いだされた。それを図9に示す。
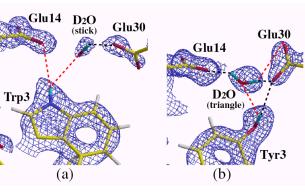
図9.ルブレドキシン野生型と変異型のコア本体のGlu30周りの水素結合の様子
PfRd(W)ではコア形成の始点に当たるTrp3がコア本体のGlu14と水素結合で直接結ばれ、またコア本体のGlu30とも水を介して繋がっている。一方、PfRd(M)ではTyr3とコア本体のGlu14は水を介して繋がり、Glu30とは水素結合で直接繋がっている。これは中性領域での構造であり、確かに。これだけでは熱安定性の違いは殆どないだろうことが予想される。また、これを酸性領域にするとPfRd(W)の熱安定せは保たれるがPfRd(M)は不安定になることが、この構造から推測できる。つまり、酸性領域でPfRd(M)はGlu30のカルボキシル基にプロトンが付加され、Glu14とTyr3を繋ぐ水分子が弾き出され、Tyr3はコア本体との繋がりがなくなる可能性が考えられる。
6.結語
中性子構造生物学では水素原子位置情報を明瞭に提供できることがお分かり頂けたかと思う。但し、最近X線構造生物学でよく言われるハイスループットからは程遠い実験手法である。最大の理由はX線源に比べて中性子源の強度不足である。しかし、ここで示したように、中性子回折法はX線で殆ど観測不可能に近い水素原子を条件を整えれば、精度高く観測できることを現実化したことは事実である。現在、中性子源の強さを向上させるために、次世代中性子源の建設が行われており、これが実現すれば約100倍の効率向上になる。また、中性子回折実験には1mm3以上の大型結晶が必要であるが、そのための単結晶育成技術も日増しに向上しており、また100倍の中性子強度増が実現すれば、その分小型の結晶で中性子回折実験が可能となる。こうなると、この分野の需要も増すことが期待される。
最近、最強の放射光X線を使い高分解能構造解析で水素原子を観測したという話が時々伝わってくる。さらにその話がエスカレートして、だから中性子は不要であると言ってさえ来る。私はこの挑戦を、水素原子はX線でどんな苦労をしてでも見たい位に重要なのであると、解釈している。しかし、中性子で簡単にできることをX線で苦労して行う必要はなく、中性子回折実験の研究環境を改善し多くの方々が中性子回折実験を容易に行うことができるようにすることの方が構造生物学の発展に最も相応しいことではないだろうか。
謝辞
本研究は日本原子力研究所先端基礎研究センター中性子構造生物学グループでの成果である。これら研究遂行に参加された方々に感謝いたします。また、科学技術振興調整費開放的融合研究の成果の一部である。
文献
1)N. Niimura, Curr. Opin. Struct. Biol. 9 (1999), 602-608.
2)N.Niimura, Y. Karasawa, I. Tanaka, J. Miyahara, K. Takahashi, H. Saito,
S. Koizumi and M. Hidaka, Nucl. Instrum. Methods. A349 (1994), 521-525.
3)I. Tanaka, K. Kurihara, T. Chatake, and N. Niimura, J. Appl. Cryst.
35 (2002), 34-40.
4)N. Niimura, Y. Minezaki, T. Nonaka, J-C. Castanga, F. Cipriani, P. Hoghoj,
M.S. Lehmann and Wilkinson, Nat Struct Biol. 4 (1997),909-914.
5)M. Maeda, S. Fujiwara, Y. Yonezawa and N. Niimura, J. Phys. Soc. Jpn.
Suppl. A, 70 (2001), 403-405
6)A. Ostermann, I. Tanaka, N. Engler, N. Niimura and F.E. Parak, Biohpys.
Chem. 95 (2002), 183-193
7)K. Kurihara, I. Tanaka, M.W.W. Adams, F.E. Jenney Jr., N. Moiseeva,
R. Bau and N. Niimura, J. Phys. Soc. Jpn. Suppl. A, 70 (2001), 400-402
8)T. Chatake, K. Kurihara, I. Tanaka, M.W.W. Adams, F.E. Jenney Jr., I.
Tsyba, R. Bau and N. Niimura, Applied Physics A75 (2002), 1-3
9)M. Maeda, T. Chatake, A. Ostermann, I. Tanaka and N. Niimura: J.Synchrotron,
(in print)
10)新村信雄,基礎科学ノート 2(1995)2-4; 新村信雄,基礎科学ノート 3(1996) 25-27; 峯崎善章、新村信雄,基礎科学ノート 4(1997)
37-40

|